27/07/2018 08:10
A água nossa de cada dia
- Institucional
O blog Estado da Arte publica o terceiro de uma série de cinco textos sobre a Maratona Piauí-Serrapilheira, com um artigo da física Marcia Barbosa

Imagem: Ben Ponsford
Fonte: Blog Estado da Arte/ Estadão
Continuando a série BITS de divulgação científica, o Estado da Arte publica o terceiro de uma série de cinco textos relacionados a cada uma das conferências apresentadas na Maratona Piauí Serrapilheira, realizada em maio no Instituto Moreira Salles no Rio de Janeiro. Nele, Marcia Barbosa, Professora Titular do Instituto de Física da Universidade Federal do Rio Grande do Sul, escreve sobre a importância da água em pesquisas recentes.
Por Marcia Barbosa
A água é um líquido estranho. Quando olhamos um copo de água gelada, não percebemos os grandes mistérios que este material guarda. Em um mundo altamente tecnológico, ficamos maravilhados com o silício, que possui a propriedade extraordinária de aumentar a sua condutividade ao ser dopado por pequenas quantidades de outro material. Esta propriedade interessante possibilitou a criação dos chips de computador mais de cem anos depois de ter sido observada pela primeira vez. Por outro lado, a água nos parece ser simples demais. Nada mais falso!
Notem: o silício tem somente uma propriedade diferente do que a maioria dos materiais apresenta, por ser um semicondutor, e já é um sucesso; a água tem mais de 70 comportamentos fora de série, e é, portanto, um material com inúmeras aplicações. Ilustremos um destes comportamentos. Se você pegar um cubo de gelo e colocar na água líquida, ele flutua, porque gelo é menos denso do que água. Isto é anormal, pois a fase sólida dos demais materiais é mais densa que sua fase líquida. Uma barra de metal, por exemplo, afunda no metal líquido. Ainda mais espetacular do que gelo flutuar em água, é água a 0º C flutuar em água a 4º C. Assim, no inverno, em locais que alcançam temperaturas negativas, os rios e lagos congelam somente na superfície, permitindo que peixes e plantas sobrevivam no fundo, que está a uma temperatura de 4º C. Isto, inclusive, permitiu que algumas plantas, insetos e pequenos animais tenham sobrevivido a uma das últimas eras glaciais, quando a Terra ficou coberta de gelo.
Outra propriedade fundamental para a vida é o calor específico, Cp, que é quanto calor tem que ser dado para um material aumentar em 1º C a sua temperatura. No caso da água, o Cp tem um valor alto, o que significa que é necessário dar muito calor para a água aumentar em 1º C a sua temperatura. Observamos isso quando vamos a uma piscina para nadar. A água durante um dia quente estará mais fria do que o concreto do piso que contorna a piscina, pois, para aumentar a temperatura da água em 1º C, é necessário fornecer mais calor do que para aumentar a temperatura do concreto. Esta propriedade extraordinária permite que os oceanos não tenham uma variabilidade de temperatura muito elevada, o que igualmente ajuda na manutenção da vida. Mas há coisas bem quotidianas nas quais podemos usar esta propriedade. Se queremos esfriar uma panela de pressão bem quente rapidamente, a colocamos em contato com a água, ao invés de a deixarmos em contato com o ar, pois a capacidade de absorver calor da água é maior do que a do ar. A indústria usa esta anomalia da água – absorver mais calor do que outros materiais – para controle de temperatura.
Além disso, água é um solvente fantástico. Água dissolve bem o sal do nosso sangue e da nossa comida, e o açúcar do nosso café. A água, no entanto, tem seus desafetos. Água detesta compostos apolares (moléculas que, diferentemente da água, são mais democráticas na sua distribuição de elétrons, e não têm acúmulo de cargas em uma dada direção), particularmente óleos. Para resolver este conflito entre água e óleo, é possível usar moléculas surfactantes, como o detergente de cozinha, que une estes dois grandes inimigos. Este jogo de amor e ódio que certos materiais têm com a água tem sua utilidade. Cobrimos o sofá da sala com um polímero que odeia água para que o mesmo não molhe e usamos materiais que amam água para absorver água do ar como, por exemplo, o sal de cozinha – se o deixamos exposto em um dia úmido, ele transforma o vapor de água em água. Isto ocorre porque o sal é polar (tem uma distribuição de carga). Em regiões áridas, se usam polímeros com grupos com cargas para fabricar redes que capturam água do ar .
Mas o que faz com que a água seja assim tão especial? A molécula de H2O em seu formato simples guarda um segredo. O oxigênio, com seus oito elétrons, para se equilibrar eletronicamente precisa de mais dois elétrons, enquanto cada hidrogênio, com somente um elétron, precisa de um elétron a mais para se equilibrar. Para resolver este problema, a natureza criou uma solução socialista, através da negociação perfeita chamada de ligação covalente. O oxigênio empresta um elétron para cada hidrogênio e cada hidrogênio empresta o seu único elétron para o oxigênio. Em média, cada hidrogênio fica com dois elétrons e cada oxigênio com dez elétrons. A ligação covalente, no entanto, não é igualitária. O oxigênio por ter mais prótons, puxa todos os elétrons para a sua vizinhança. Os hidrogênios ficam com os elétrons, mas estes não ficam próximos ao H e sim ao O, ficando a molécula polarizada. Surge assim a “ligação de hidrogênio”.
Enquanto a ligação covalente é entre átomos, a de hidrogênio é entre moléculas, sendo esta última bem mais fraca do que a primeira. Se a ligação covalente é um casamento entre o oxigênio e o hidrogênio, a ligação de hidrogênio é um flerte fortuito entre o hidrogênio de uma molécula e o oxigênio da molécula vizinha. Devido ao formato em V das ligações covalentes, como ilustra a figura 1.
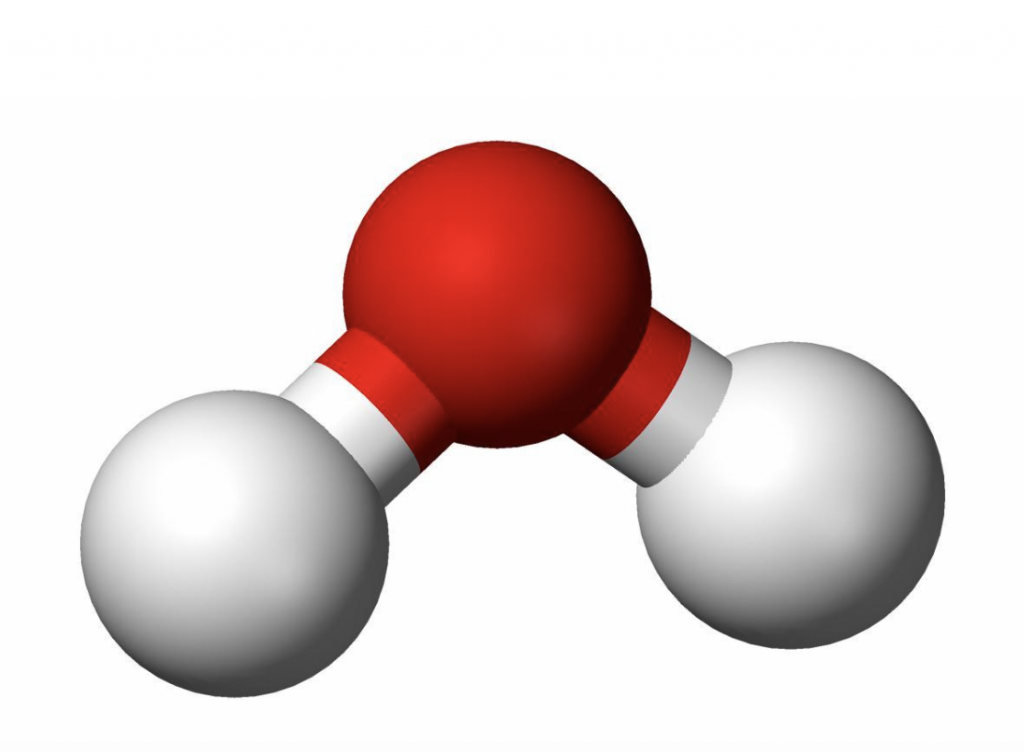
Figura 1 – O oxigênio é representado pela esfera vermelha, e os hidrogênios pelas brancas. (Imagem: Creative Commons)
Cada molécula de água pode formar até quatro ligações de hidrogênio. Imagine você estar no centro de um cubo, com os dois braços apontando para dois vértices em diagonais opostas da face superior do cubo e os dois pés apontando para dois vértices em diagonais opostas na face inferior do cubo, alternadas em relação às superiores, como ilustra a figura 2.
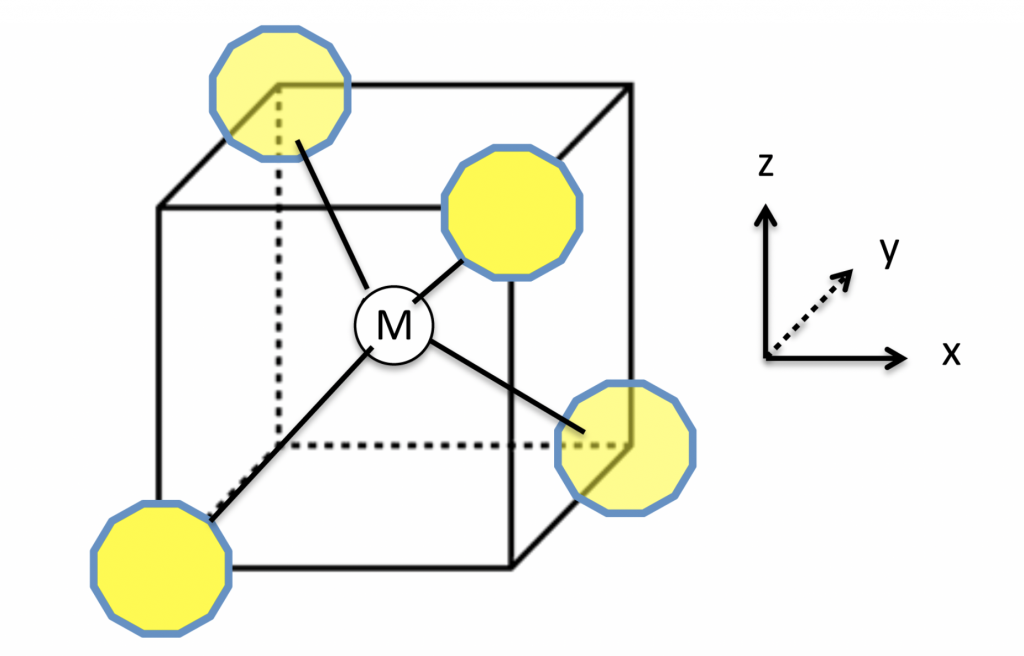
Figura 2 – M representa uma molécula central de água que se liga com outras quatro (em amarelo) através de ligações de hidrogênio com direções e distâncias específicas. (Imagem: Creative Commons)
As quatro ligações de hidrogênio são exatamente assim. Note que elas têm uma distância e ângulo bem precisos. Assim, a baixas temperaturas, o gelo forma todas as ligações possíveis, mas ao aumentar a temperatura algumas ligações são rompidas, o que permite que as moléculas se aproximem, aumentando a densidade e, por isso, o gelo é menos denso que a água a 4º C. A presença das ligações também explica o calor específico elevado, pois é necessário dar calor para romper a ligação e, somente depois de rompida, aumentar a temperatura. Materiais que têm cargas livres, como o sal de cozinha, ou que formam ligações de hidrogênio com a água, como os álcoois, amam a água e se dissolvem bem na água; materiais sem cargas, como os polímeros que usamos para cobrir o sofá da nossa casa, odeiam água e não se solubilizam em água e, por isso, são ótimos para impedir que algo se molhe.
Além de propriedades termodinâmicas, a água se move de maneira peculiar. Na grande maioria dos materiais, a mobilidade das moléculas aumenta com a diminuição da densidade do sistema, pois o espaço para se mover aumenta. Se queremos fazer o óleo fluir mais, aumentamos a temperatura para diminuir a densidade. Na água, no entanto, a baixas temperaturas a mobilidade aumenta com o aumento da densidade. As moléculas de água a altas densidades têm ligações de hidrogênio muito promíscuas que se formam e se desfazem rapidamente, permitindo à água se mover de uma molécula vizinha à outra. A água se comporta como um bando de foliões no carnaval, onde a densidade de pessoas é enorme: as pessoas se movem rapidamente, largando o braço de um companheiro de bloco e passando ao braço de outro. Uma consequência interessante desta alta mobilidade é que se colocarmos a água confinada em tubos muito fininhos (10.000 vezes mais finos do que um fio de cabelo), a água flui através do tubo a uma velocidade que pode ser até 1.000 vezes maior do que se espera para a maioria dos materiais. O que ocorre é que a água confinada em volumes pequenos se move usando a rede de ligações de hidrogênio. Para um tubo bem fininho, as moléculas formam uma linha compacta, que se move como se fosse um tubo dentro de outro tubo como mostra a figura 3. Este fenômeno tem uma aplicação muito importante.
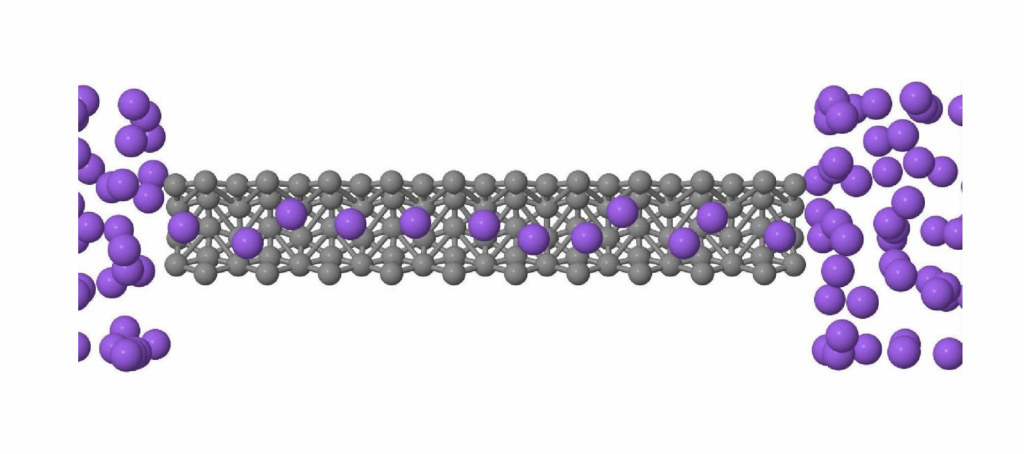
Figura 3 – Nanotubo em cinza e água em roxo. As moléculas fazem uma fila no superfluxo. (Imagem da autora)
Qual a utilidade deste superfluxo? Hoje uma em cada seis pessoas no mundo vive em regiões onde há stress hídrico, ou seja, vivem em regiões que não têm água suficiente para produzir a sua subsistência, e este número em 2030 irá chegar a 50% da população. No Brasil, temos regiões que não têm água suficiente para a sobrevivência, e o crescimento não planejado da agricultura adicionado ao uso indiscriminado de agrotóxicos tem levado a situações de falta de água em regiões como São Paulo. Este quadro, com o crescimento da população, mudança do clima e contaminação da água potável, irá se agravar mundialmente nos próximos anos.
Uma solução que se usa para isso é a dessalinização de água do mar ou salobra. Hoje na Califórnia, em algumas ilhas do Caribe, em diversos países do Oriente Médio e na ilha de Fernando de Noronha, a dessalinização é uma realidade. Uma alternativa é o processo de osmose reversa, usado na Califórnia, que consiste em empurrar a água através de um filtro que permite a passagem de água, mas não a de sal. Este processo é caro e ineficiente, pois as plantas de dessalinização são instalações enormes e se justificam somente para abastecer grandes cidades, pois o processo não tem um equivalente em pequena escala. O defeito deste processo é que não usa nenhuma das propriedades mágicas da água.
Com a descoberta recente do superfluxo da água confinada, alguns pesquisadores têm proposto o uso de nano estruturas para separar a água do sal. A água atravessa os nanotubos de carbono com um superfluxo e o sal, devido à barreira dielétrica da membrana nanométrica, fica fora da membrana. Para que o processo ocorra, os poros devem ter 2 nanômetros de diâmetro, o que por si só é um desafio para a produção em série. A boa nova é que testes laboratoriais realizados na Universidade da Califórnia e testes computacionais realizados por diversos grupos, inclusive o do Instituto de Física da Universidade Federal do Rio Grande do Sul que coordeno, mostraram que este processo seria em ordens de grandeza mais eficiente do que aquele usado atualmente, tornando as plantas de dessalinização mais eficientes, exigindo um consumo menor de energia e filtros menores, ou seja, factíveis para pequenas cidades ou mesmo para bairros. Esperamos que com o desenvolvimento de tecnologias de larga escala para a produção de nanotubos, grafeno ou do MoS2 em quantidade suficiente para construir membranas, em dez anos esta tecnologia esteja implementada no mundo ou, quem sabe se voltarmos a ter um financiamento regular e ininterrupto em ciência e tecnologia, mesmo no Brasil.
Marcia Barbosa é Professora Titular do Instituto de Física da Universidade Federal do Rio Grande do Sul, Bolsista 1B de Produtividade em Pesquisa do CNPq e Diretora na Academia Brasileira de Ciências. Em 2013, recebeu o Prêmio L’Oréal-UNESCO Para Mulheres na Ciência
